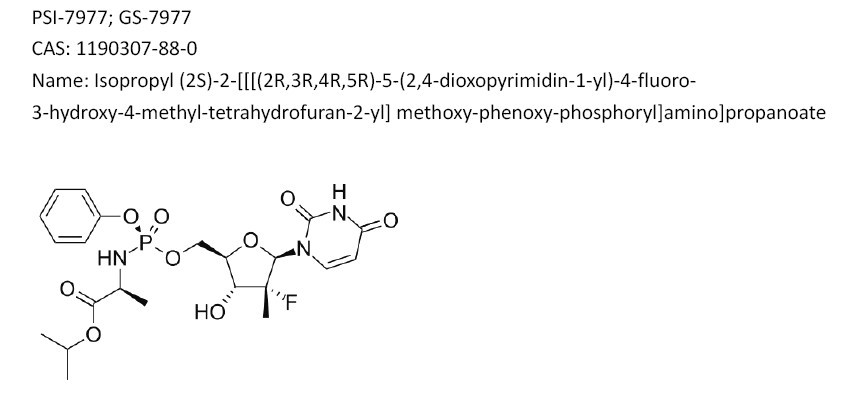
美国吉里德科学公司于当地时间2013年4月8日发布消息称,该公司已于日前向FDA递交了新药sofosbuvir的NDA,寻求FDA批准该药作为一天口服一次核苷类似物类药物用于治疗慢性丙肝病毒(HCV)感染。根据所递交的NDA数据,sofosbuvir可与利巴韦林一起口服用于治疗基因2、3型HCV感染,或与利巴韦林及聚乙二醇干扰素联合给药,用于治疗先前未接受过抗病毒药物治疗的基因1、4、5、6型HCV感染。
全美共有约400万人罹患HCV感染,在出生于1946~1964之间出生的人群内,HCV的感染情况尤为严重。在美国,HCV感染是导致肝癌与肝移植的主要原因之一。聚乙二醇干扰素注射给药24~48周是目前主要的HCV感染治疗方法,但该药需要注射用药,且可引起严重的不良反应,使得部分患者无法完成全疗程用药。如果批准,sofosbuvir能将HCV的治疗疗程缩短至12~16周,而且可根据基因型的不同,免除聚乙二醇干扰素的使用或缩短其用药疗程。
吉里德公司总裁及CEO John C. Martin表示,目前现有的HCV治疗方法,在大部分患者内均不适用,而且使用不便、耐受性差。Sofosbuvir抗病毒效力强、安全性良好,而且每天只须用药一次,因此可能会简化HCV的治疗程序,缩短治疗疗程,从而改善治愈率。
2011年1月,吉里德科学公司曾经以110亿美元的高价收购了Pharmasset Inc,并获得了sofosbuvir的开发与营销权。虽然曾经一度因为出价过高而备受指责,但sofosbuvir在临床试验中所表现出的优良有效性与安全性,使得吉里德科学公司有望成为HCV用药市场的领头羊。
2011年,FDA批准了默克公司的boceprevir与Vertex公司的Telaprevir用于治疗基因1型HCV感染,但两种药物均需每天用药三次。2012年两者的销售额分别为与5.02亿美元与11.62亿美元。
第200880018024.2号专利即为sofosbuvir在中国申请的化合物专利, 目前尚处于实质审查阶段,如果获得授权,将于2028年2月25日失效。